Partenaire 3
Physiopathologie et Epidémiologie des Maladies Respiratoires
Directeur du partenaire
marina.petrolani@inserm.fr - 0157277586Les axes de recherche :
L’Inserm UMR1152 étudie les facteurs de risque et les mécanismes cellulaires et moléculaires impliqués dans la survenue et la progression des maladies respiratoires, en particulier, l’asthme, la bronchopneumopathie bronchique obstructive (BPCO) et les fibroses pulmonaires, soit idiopathiques (FPI), soit associées aux lésions pulmonaires aigues (‘acute lung injury’, ALI, et le syndrome de détresse respiratoire aigu, SDRA). Des approches cliniques, épidémiologiques et de recherche fondamentale sont utilisées pour déterminer l’origine de ces maladies et de l’inflammation et la fibrose tissulaires qui les accompagnent. Un intérêt particulier est porté sur (i) l’analyse des mécanismes impliqués dans la perte de l’intégrité de l’épithélium respiratoire et dans les anomalies du processus de réparation, et (ii) sur l’étude de l’origine des fibroblastes pulmonaires (transition épithélio-mésenchymateuse, différenciation à partir de fibrocytes ou en myofibroblastes) et dans leurs altérations fonctionnelles (survie/apoptose, migration, prolifération).
Le partenaire 3 d’Inflamex regroupe 4 équipes de recherche:
Equipe 1 – Epidémiologie respiratoire : de l’étiologie de l’asthme et de la BPCO au pronostic de la transplantation pulmonaire
Contact : Pr Gabriel Thabut (gabriel.thabut@bch.aphp.paris.fr / 01.40.25.69.12)
Equipe 2 – Inflammation et remodelage bronchiques dans les maladies pulmonaires obstructives
Contact : Dr Marina Pretolani (marina.pretolani@inserm.fr / 01.57.27.75.86) et Pr Michel Aubier (michel.aubier@bch.aphp.fr / 01.40.25.68.00)
Equipe 3 – Inflammation et fibrogénèse pulmonaire
Contact : Pr Bruno Crestani (bruno.crestani@bch.aphp.paris.fr / 01.40.25.86.86)
Equipe 4 – Immunité innée et défenses pulmonaires anti-infectieuses
 A la surface de l’épithélium pulmonaire et alvéolaire, les cellules épithéliales et les cellules myéloides de l’immunité innée (macrophages alvéolaires, cellules NK, lymphocytes innés..) interagissent, par l’intermédiaire de la sécrétion de surfactant, cytokines et chimokines régulatrices et molécules anti-microbiennes, afin de maintenir un phénotype régulateur non-inflammatoire. Après exposition à des stimuli toxiques ou infectieux, ces cellules participent en réseau pour organiser l’induction de l’inflammation, et pour engager l’immunité adaptative afin de contenir l’agression et assurer un retour à l’homéostasie. Notre groupe de recherche est principalement intéressé par les mécanismes de l’immunité innée mis en place dans ce processus, et par les mécanismes de dérégulation de ceux-ci, qui pourraient expliquer la pathophysiologie de certaines pathologies inflammatoires (bronchopneumopathie chronique obstructive, mucoviscidose…).
A la surface de l’épithélium pulmonaire et alvéolaire, les cellules épithéliales et les cellules myéloides de l’immunité innée (macrophages alvéolaires, cellules NK, lymphocytes innés..) interagissent, par l’intermédiaire de la sécrétion de surfactant, cytokines et chimokines régulatrices et molécules anti-microbiennes, afin de maintenir un phénotype régulateur non-inflammatoire. Après exposition à des stimuli toxiques ou infectieux, ces cellules participent en réseau pour organiser l’induction de l’inflammation, et pour engager l’immunité adaptative afin de contenir l’agression et assurer un retour à l’homéostasie. Notre groupe de recherche est principalement intéressé par les mécanismes de l’immunité innée mis en place dans ce processus, et par les mécanismes de dérégulation de ceux-ci, qui pourraient expliquer la pathophysiologie de certaines pathologies inflammatoires (bronchopneumopathie chronique obstructive, mucoviscidose…).
Thèmes de recherche:
Trois domaines d’investigation sont principalement étudiés par notre équipe :
1) Etude in vitro et in vivo du rôle des infections à Pseudomonas aeruginosa (un pathogène opportuniste présent dans les infections pulmonaires nosocomiales et dans la mucoviscidose) et de leur rôle dans les exacerbations des maladies pulmonaires chroniques.
2) 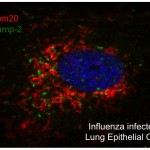 Etude in vitro et in vivo des mécanismes par lesquels le virus Influenza, un pathogène responsable des infections dans la grippe saisonnière et épisodes de pandémie grippale, favorise les sur-infections bactériennes et induit les exacerbations des maladies pulmonaires chroniques.
Etude in vitro et in vivo des mécanismes par lesquels le virus Influenza, un pathogène responsable des infections dans la grippe saisonnière et épisodes de pandémie grippale, favorise les sur-infections bactériennes et induit les exacerbations des maladies pulmonaires chroniques.
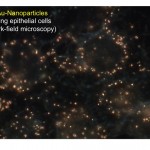
3) Investigation des mécanismes d’action des nanoparticules dans le poumon, seules ou en conjonction avec des pathogènes pulmonaires (S. aureus, P.aeruginosa, Influenza virus…).
Les processus moléculaires, techniques, réactifs, voies de signalisation étudiés et utilisés incluent :
Mécanismes d’activation des récepteurs aux ‘Pathogen Associate Molecular Pattern/PAMP’ ; processus phagocytaires ; voies de signalisation ; rôle des ‘type 2 serine proteases (TTSPs)’ lors de l’infection à Influenza ; interactions entre facteurs de virulence microbiens, récepteurs de l’immunité innée et canaux épithéliaux (notamment le CFTR) ; étude des molécules antimicrobiennes endogènes ; utilisation de vecteurs adénoviraux recombinants ; modèles murins d’infection pulmonaire ; RT-qPCR ; cytométrie de flux ; immuno-histochimie ; protéomique
Enseignement lié à l’équipe: Master Infectiologie
Publications récentes mises en avant:
[Modifying the Protease, Antiprotease Pattern by Elafin Overexpression Protects Mice From Colitis]
Motta JP, Magne L, Descamps D, Rolland C, Squarzoni-Dale C, Rousset P, Martin L, Cenac N, Balloy V, Huerre M, Jenne D, Wartelle J, Belaaouaj A, Mas E, Vinel JP, Alric L, Chignard M, Vergnolle N, Sallenave J-M.
Gastroenterology. 2011; 140:1272-82
[Toll-like receptor 5 (TLR5), IL-1β secretion, and asparagine endopeptidase are critical factors for alveolar macrophage phagocytosis and bacterial killing]
Descamps D, Le Gars M, Balloy V, Barbier D, Maschalidi S, Tohme M, Chignard M, Ramphal R, Manoury B, Sallenave JM.
Proc Natl Acad Sci U S A. 2012;109:1619-24.
[A role for 12R-lipoxygenase in MUC5AC expression by respiratory epithelial cells]
Garcia-Verdugo I, BenMohamed F, Tattermusch S, Leduc D, Charpigny G, Chignard M, Ollero M, Touqui L.
Eur Respir J. 2012 ;40:714-23
[Overexpressing mouse model demonstrates the protective role of Muc5ac in the lungs]
Ehre C, Worthington EN, Liesman RM, Grubb BR, Barbier D, O’Neal WK, Sallenave JM, Pickles RJ, Boucher RC.
Proc Natl Acad Sci U S A. 2012;109:16528-33
[Neutrophil elastase degrades cystic fibrosis transmembrane conductance regulator via calpains and disables channel function in vitro and in vivo]
Le Gars M, Descamps D, Roussel D, Saussereau E, Guillot L, Ruffin M, Tabary O, Hong SS, Boulanger P, Paulais M, Malleret L, Belaaouaj A, Edelman A, Huerre M, Chignard M, Sallenave JM.
Am J Respir Crit Care Med. 2013;187:170-9



